
Stworzenie układu okresowego pierwiastków
W 1869 roku rosyjski chemik, Dmitrij Mendelejew, przedstawił opracowany przez siebie układ pierwiastków. Wszystkie znane wtedy pierwiastki chemiczne uszeregował według rosnących mas atomowych. Mendelejew dostrzegł prawidłowość w skonstruowanej przez siebie tabeli – właściwości pierwiastków powtarzały się okresowo, stąd też pochodzi nazwa tej tabeli. W czasach Mendelejewa znano jedynie około 90 pierwiastków, jednakże rosyjski naukowiec był w stanie przewidzieć, że istnieją też nieodkryte dotąd pierwiastki. Starał się określać ich właściwości na podstawie tego, gdzie powinny być w układzie okresowym.
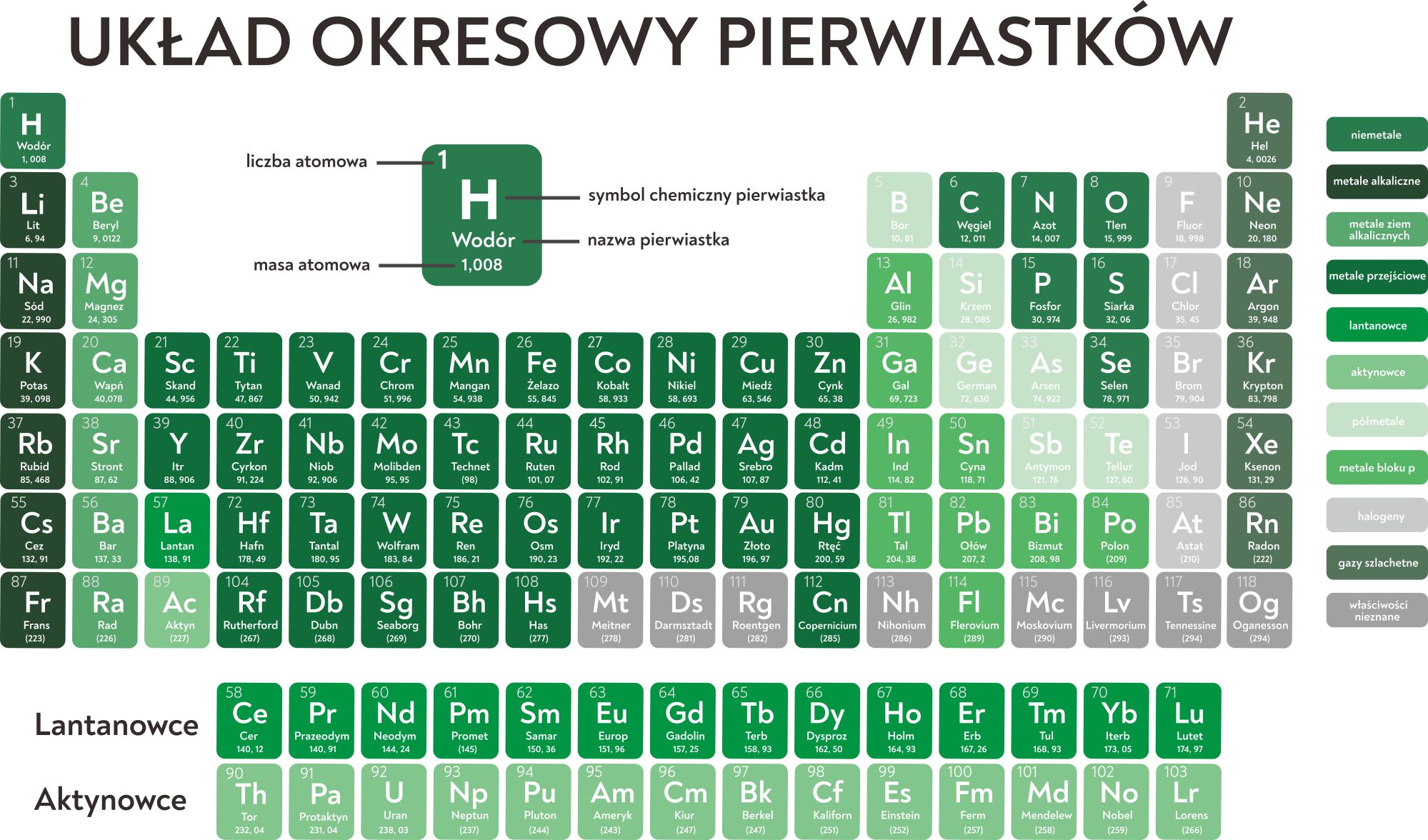
Formy układu okresowego
Najbardziej podstawową formą układu okresowego jest tabela z ponumerowanymi grupami i okresami oraz symbolami i numerami wszystkich pierwiastków, od 1 do 118, gdzie numer ten określa liczbę atomową pierwiastka. Występują bardziej złożone wersje, z podanymi innymi informacjami, na przykład masami atomowymi, pełnymi nazwami. Często w układzie okresowym jest też zaznaczone, które pierwiastki są metalami, a które niemetalami.
Znaczenie grup w układzie okresowym pierwiastków
Każda z grup zawiera pierwiastki o podobnych właściwościach. Wyjątkiem jest wodór, który ma inne właściwości niż pozostałe pierwiastki z pierwszej grupy, nie jest też metalem. Grupom nadano nazwy od pierwszego pierwiastka w grupie. Z 18 grup układu okresowego 8 to grupy główne – 1 i 2 grupa oraz grupy od 13 do 18. Pozostałe grupy, od 3 do 12, określane są grupami pobocznymi. Numer grupy głównej informuje o maksymalnej wartościowości pierwiastka – ile wiązań tworzy dany pierwiastek. Dla grup 1 i 2 wartościowość jest równa numerowi grupy, dla pozostałych grup głównych wartościowość to numer grupy minus 10. I tak na przykład węgiel znajduje się w 14 grupie, więc ma maksymalną wartościowość IV. Jednakże w 18 grupie znajdują się helowce, tak zwane gazy szlachetne, które nie są reaktywne. Bardzo ciężko jest otrzymać związki chemiczne helowców, więc w praktyce najbardziej typowa dla nich wartościowość to zero.
Źródło zróżnicowania właściwości chemicznych pierwiastków
Rodzi się pytanie co jest przyczyną różnego charakteru chemicznego poszczególnych pierwiastków. Otóż różnice we właściwościach chemicznych wynikają z różnej konfiguracji elektronowej, konfiguracji elektronów walencyjnych. Zapis całej konfiguracji elektronowej atomu danego pierwiastka można też odczytać z jego położenia w układzie okresowym. Elektrony w atomie położone są na powłokach, podpowłokach i orbitalach. Ostatnia powłoka, najdalej wysunięta od jądra, to powłoka zawierają elektrony walencyjne, czyli te, które uczestniczą w tworzeniu wiązań chemicznych. Stąd też konfiguracja elektronów walencyjnych ma decydujące znaczenie o właściwościach chemicznych pierwiastka.
Układ okresowy pierwiastków można podzielić ze względu na konfigurację elektronową, biorąc pod uwagę, która podpowłoka jest obecnie wypełniana elektronami. Wyróżniamy pierwiastki bloku s, gdzie wypełniana jest podpowłoka s powłoki walencyjnej, tworzą ją pierwiastki grup 1 i 2 oraz hel. Oprócz tego są metale bloku d grup pobocznych, gdzie wypełniana jest podpowłoka d przedostatniej powłoki oraz lantanowce i aktynowce tworzące blok f, gdzie wypełniana jest podpowłoka f powłoki n-2, gdzie n to liczba wszystkich powłok pierwiastka. Ostatni blok pierwiastków to blok p, tworzą go pierwiastki grup 13-18. Atomy tych pierwiastków mają kolejno wypełnianą podpowłokę p powłoki walencyjnej.
Numer okresu informuje nas o liczbie wszystkich powłok elektronowych. Numer grupy dostarcza informacji o liczbie elektronów walencyjnych, w przypadku grup głównych. Dla grup głównych 13-18 jest to numer grupy minus 10. Stąd wynika wspomniany sposób określania maksymalnej wartościowości dla grup głównych.
Elektroujemność, metale i niemetale
Elektroujemność to stopień w jakim atom przyciąga elektrony. Wynika ona z konfiguracji elektronowej. Najbardziej elektroujemne pierwiastki, to te, w których powłoka walencyjna jest prawie zapełniona i znajduje się blisko jądra. Blisko położone dodatnio naładowane jądro silnie przyciąga elektrony. Elektroujemność rośnie więc w okresie, gdzie powłoka walencyjna jest coraz bardziej zapełniona elektronami i jednocześnie jądro ma coraz większy ładunek dodatni, silniej przyciągając elektrony cały czas tej samej powłoki walencyjnej. Natomiast elektroujemność maleje w grupie. Z każdym kolejnym okresem powłoka walencyjna jest bardziej oddalona od jądra, więc słabiej przyciąga elektrony walencyjne. Jednocześnie elektrony z innych powłok odpychają elektrony walencyjne. Pierwiastki w dół grupy zyskują większą skłonność do oddawania elektronów, czyli elektrododatniość, wraz z malejącą elektroujemnością.
Z pojęciem elektroujemności i elektrododatniości związany jest podział pierwiastków na metale i niemetale. Metale są bardziej elektrododatnie, a niemetale bardziej elektroujemne. Zrozumiałe jest więc, że metale znajdują się w pierwszych grupach układu okresowego oraz w wyższych okresach. Powszechne powinny być wiązania między pierwiastkami o wyraźnym charakterze metalicznym i niemetalicznym, gdzie występuje duża różnica elektroujemności, na przykład związek chemiczny sodu i chloru, NaCl. Oprócz pierwiastków o określonej elektroujemności występuje wspomniana już grupa helowców, dla której nie podaje się elektroujemności. Wynika to oczywiście z konfiguracji elektronów walencyjnych. Helowce mają zapełnioną ostatnią powłokę, więc nie mają skłonności ani do przyjmowania, ani do oddawania elektronów.
Układ okresowy pierwiastków podstawą wiedzy chemicznej
Chemia nie może istnieć bez układu okresowego, stanowi on podstawowe źródło informacji o właściwościach chemicznych wszystkich pierwiastków. Nauk chemiczne opierają się na tym jak zbudowany jest atom, jaką konfigurację elektronową mają poszczególną pierwiastki. Informacje o konfiguracji elektronowej, a także liczbie protonów w jądrze znajdują się właśnie w układzie okresowym pierwiastków.






![Aceton czda min. 99,5% [67-64-1] Aceton czda min. 99,5% [67-64-1]](images/loader.gif)
